升上國中之後,我們會遇到很多新的科目,像是自然科就會分成生物、理化、地科,學習的內容會變得更深更廣,其中在理化科當中,「溶解度」就是一個很重要的單元,也是之後會考裡的重點考題之一,也因此下面我們會為大家介紹什麼是溶解度,以及相關的常見例題,讓你可以更快速的了解溶解度。
內容目錄
Toggle什麼是溶解度?
溶解度的英文是 Solubility,也因此他的代表符號都會用 S 來表示,是表示定溫下,定量的溶劑所能溶解溶質的最大量,主要會受到物質本性、溫度以及壓力的影響,常用的表示方法有很多種,比較常見的是「重量百分濃度」,表示每100克溶劑中所含的溶質克數;以及「體積莫耳濃度」,表示每公斤溶液所能溶解的莫耳數。
溶解度與溶液的關係:認識溶劑、溶質與溶液
在開始正式介紹之前,我們需要先了解溶劑、溶質和溶液之間的關係,溶劑是可以溶解其他東西的物質;溶質是被溶解的物質;而溶液則是由溶劑和溶質所組成,舉例來說發泡錠溶於水中所形成的液體,就可以寫成「發泡錠(溶質) + 水 (溶劑) = 液體 (溶液)」。

溶液的種類主要又有三種分法,一種是根據溶液的狀態,可以分成氣態溶液、液態溶液、以及固態溶液;一種則是根據溶劑是不是水來分類,如果溶劑是水就稱為水溶液,不是水的話就是非水溶液;另一種是根據溶解度來做分類,分成飽和溶液、未飽和溶液和過飽和溶液。
溶解與沉澱
- 溶解 (Dissolution):溶解是指溶質的分子離開溶質表面均勻溶在溶劑當中的現象。
- 沉澱 (Precipitation):沉澱是指已經溶解的溶質經過碰撞聚集成大顆粒後,又在溶液當中析出的現象,也稱為結晶。
- 溶解平衡:而當溶質的溶解速率和沈澱速率相等的時候就可以成為溶解平衡。
飽和溶液
飽和溶液是指在定溫定壓下,溶劑所能溶解的溶質已經達到最大值,沒辦法再溶解同一溶質。在這個時候,溶質的溶解速率會和沈澱速率相等,達到溶解平衡。定溫下的溶液的濃度會與溶解度相等。
未飽和溶液
未飽和溶液是指未達飽和的溶液,還可以再繼續溶解同一溶質,想要達到飽和的方法主要有三種:
- 增加溶質,直到不能再被溶解
- 透過蒸發的方式減少溶劑
- 改變溫度
在這個時候溶液的溶解度會大於定溫下的濃度。
過飽和溶液
過飽和溶液是一個不穩定的狀態,只要加入少數的晶體或者是攪拌,都可以讓過量的溶質析出,變成飽和溶液。想要讓過飽和溶液達到飽和的方式主要有三種:
- 加入溶質或結構相近的固體
- 攪拌和震動
- 改變溫度
在這個時候定溫下的濃度會大於溶解度的溶液。
| 溶液類型 | 飽和溶液 | 未飽和溶液 | 過飽和溶液 |
|---|---|---|---|
| 定溫下濃度與溶解度 | 濃度=溶解度 | 濃度<溶解度 | 濃度>溶解度 |
| 如何達到飽和 | 已達成溶解平衡 | 1. 增加溶質,直到不能再被溶解 2. 透過蒸發的方式減少溶劑 3. 改變溫度 | 1. 增加溶質 2. 攪拌和震動 3. 改變溫度 |
影響溶解度的因素:物質本性、壓力及溫度
未飽和溶液和過飽和溶液都可以透過一些方式達到飽和,其實會影響液體溶解度的原因有許多,主要可以分成三種:物質的本性、壓力、以及溫度。
物質的本性
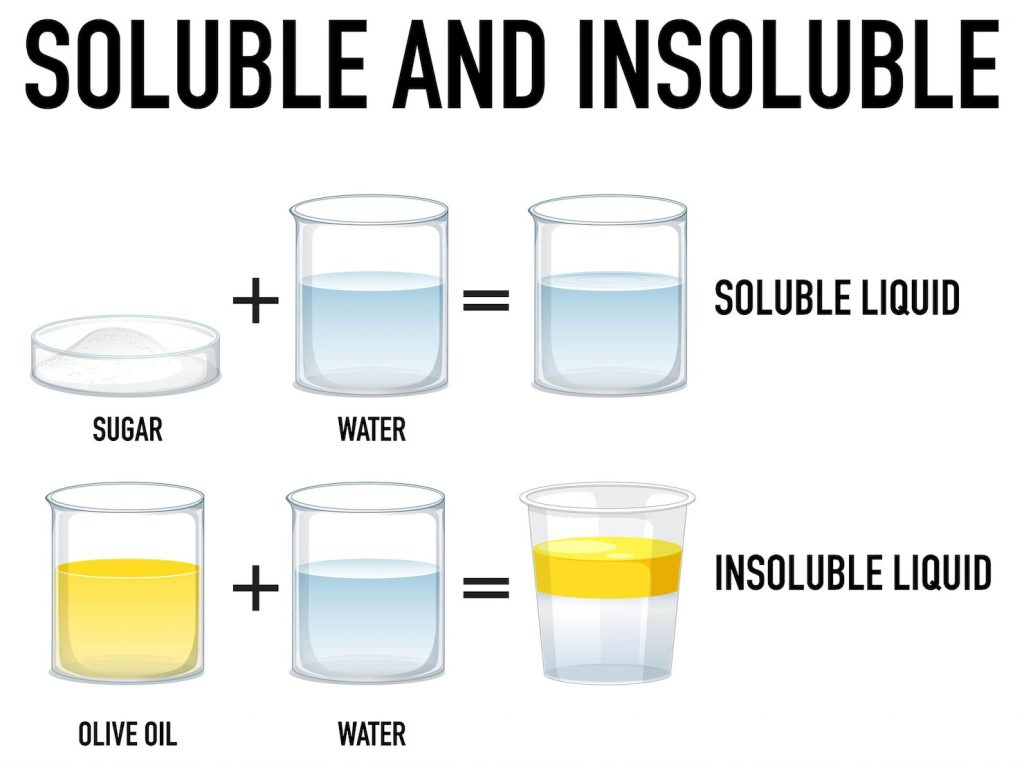
溶質和溶劑有相似性質時,會有較大的溶解度,又稱為同類互溶,極性分子易溶於極性分子中,而非極性分子易溶於非極性分子中,像是鹽(極性)易溶於水(極性)中;但是油(非極性)難溶於水中。
壓力
在溶質是固體或液體時,壓力對於溶解度的影響比較小,但如果溶質是氣體,壓力對於其溶解度的影響很大,在定溫下,如果壓力增加,氣體的溶解度也會增加,舉例來說汽水中的二氧化碳是由加大壓力的方式使其溶解於汽水當中,在我們打開瓶蓋,壓力減小之後,溶解度就會降低,二氧化碳也會冒出來。

溫度
溫度也是會影響液體溶解度的因素之一,溶質溶解於溶液時,溫度對於吸熱反應和散熱反應的效應不同。大部分的固體溶質,溶解是吸熱反應,會隨水溫的升高而增加,從飽和溶液變成非飽和溶液;而少部分固體溶質,像是氫氧化鈣、氫氧化鈉溶解於水中是放熱反應,溶解度隨水溫的升高而降低。

常見的溶解度表示法與算法
接著要和大家介紹考試中常見的溶解度表示法還有其算法,除了上面所提到的體積莫耳濃度和重量百分濃度以外,其實還有三種表示法:重量莫耳濃度、莫耳分率和 ppm。
重量百分濃度(P%)
重量百分濃度 (P%) 表示每100克溶劑中所含的溶質克數。
算法: P% = 溶質(g) / 100g溶液 x 100%
體積莫耳濃度(M)
體積莫耳濃度 (M) 表示的是每公升溶液當中所含的溶質莫耳數。
算法:M = 溶質(mole) / 溶液(L)
重量莫耳濃度(m)
重量莫耳濃度 (m) 表示的是每1000克的溶劑當中所含的溶質莫耳數。
算法:m = 溶質(mole) / 溶劑(kg)
莫耳分率(Xi)
莫耳分率 (Xi) 表示的是在一莫耳溶液當中溶質所佔的莫耳數。
算法:Xi = 溶質莫耳數(mole) / 溶液莫耳數(mole)
百萬分之一(ppm)
百萬分之一 (ppm) 表示的是每百萬 (10⁶) 克溶液當中所含溶質的克數。
算法:ppm = 溶質克數(g) / 溶液重 x 10⁶ = 溶質毫克數(mg) / 水溶液體積(L)
釐清溶解度觀念|溶解度常見例題一次看!
均一教育平台 Junyi Academy
劉維自然·康軒參考書作者
台北酷課雲
其他溶解度補充資料
國二理化的範圍主要是以水為溶劑來介紹的,如果在學習完後對於理化這個科目很有興趣,想對溶解度有更進一步的理解,例如可溶、難溶圖表或者常見的沉積物都可以去參考這個網站。
國中理化考前觀念衝刺,就上AmazingTalker找理化家教!
總合以上,有幫大家整理出了和溶解度相關的各個重要知識,包括溶劑、溶質和溶液三者之間的關係、影響溶解度的因素、常見的溶解度表示法以及一些可以更加了解溶解度這個單元的 Youtube 頻道和網站,希望能夠幫助到也在努力學習理化的大家,在考前要多多練習相關的題目,這樣在考試中就可以很好的運用所學的知識,發揮自己完整的實力。如果你正在尋找能夠幫助你有效吸收物理、化學的老師,AmazingTalker現在已有多位台大、清大等理化家教師資,可以根據你的需求制訂專屬學習計畫,單堂購買不需擔心綁定一學期課程,體驗課機制讓你上課更安心!




























